جواب باهم بیندیشیم صفحه ۱۰۸ و ۱۰۹ شیمی دوازدهم تجربی و ریاضی ؛ در این مقاله به پاسخ و جواب سوالات تمرین با هم بیندیشیم صفحه ی 108 و 109 فصل چهارم شیمی راهی به سوی آیندهای روشن کتاب شیمی دوازدهم تجربی و ریاضی فیزیک متوسطه دوم پرداخته ایم. در ادامه با بخش آموزش و پرورش ماگرتا همراه ما باشید.
بعدی: جواب خود را بیازمایید صفحه ۱۱۰ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۱۲ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۱۴ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۱۶ شیمی دوازدهم
جواب باهم بیندیشیم صفحه ۱۱۷ شیمی دوازدهم

پاسخ و حل با هم بیندیشیم صفحه ۱۰۸ و ۱۰۹ شیمی دوازدهم تجربی و ریاضی
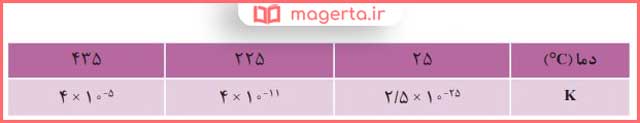
۱- جدول داده شده اثر دما را بر ثابت تعادل زیر نشان میدهد. با توجه به آن به پرسشها پاسخ دهید.
2SO3(g) ⇌ 2SO2(g) + O2(g)
آ) عبارت ثابت تعادل را برای آن بنویسید.
پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:

ب) میزان پیشرفت واکنش در کدام دما بیشتر است؟ چرا؟
پاسخ: دمای 435 درجه ، زیرا ثابت تعادل در این دما عدد بزرگتری است. به این معنا که واکنش در این دما به سمت تولید فراورده، پیشرفت بیشتری داشته است.
پ) با افزایش دما K چه تغییری کرده است؟ این تغییر، جابه جا شدن تعادل را در چه جهتی نشان میدهد؟
پاسخ: با افزایش دما K بزرگتر شده است، یعنی تعادل در جهت واکنش رفت جابهجا شده است.
ت) اگر برای این واکنش ΔH > 0 باشد، جا به جا شدن تعادل و افزایش K را به کمک اصل لوشاتلیه توجیه کنید.
پاسخ: با افزایش دما و بزرگتر شدن K متوجه میشویم که تعادل گرماگیر است.
طبق اصل لوشاتلیه ← با افزایش دما (T) واکنش به سمت مصرف گرما پیش میرود و تعادل به سمت واکنش گرماگیر جابهجا میشود، یعنی تعادل به سمت واکنش رفت پیش میرود.
۲- با خط زدن واژه نادرست در هر مورد، عبارت زیر را کامل کنید.
پاسخ: در زیر واژه درست را با رنگ آبی و واژه نادرست را با خط زدن مشخص کرده ایم.
هنگامی که دمای یک سامانه تعادلی افزایش مییابد، واکنش در جهت (مصرف / تولید) گرما پیش میرود، اگر این واکنش گرماگیر باشد مقدار (فراوردهها / واکنش دهندهها) در سامانه کاهش مییابد.
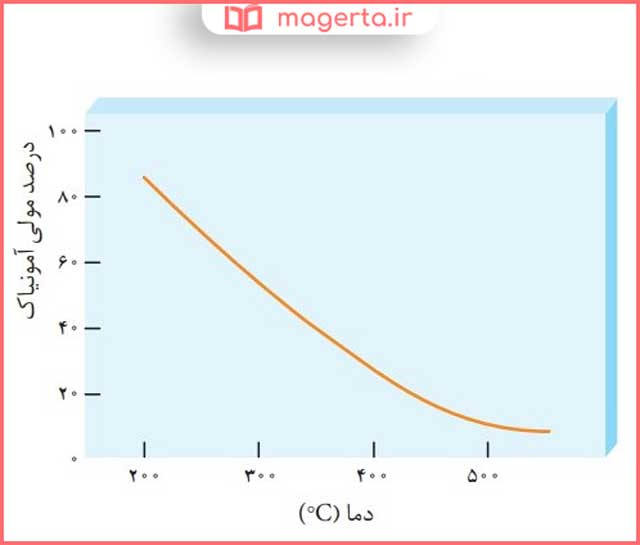
۳- نمودار زیر درصد مولی آمونیاک را برای سامانه تعادلی زیر در فشار ثابت نشان میدهد. باتوجه به آن به پرسشها پاسخ دهید.
N2(g) + 3H2(g) ⇌ 2NH3(g)
آ) با افزایش دما درصد مولی آمونیاک در سامانه چه تغییری میکند؟
پاسخ: کاهش مییابد.
ب) این واکنش گرماده است یا گرماگیر؟ چرا؟
پاسخ: گرماده ، زیرا با افزایش دما واکنش در جهت مصرف آمونیاک یعنی در جهت برگشت جا به جا شده است، پس q در سمت راست معادله قرار دارد و واکنش گرماده است.
N2(g) + 3H2(g) ⇌ 2NH3(g) + q
پاسخ دیگر: واکنش گرماده است، زیرا با افزایش دما طبق اصل لوشاتلیه واکنش باید در جهت مصرف گرما (گرماگیر) پیش رود. با توجه به کاهش درصد مولی آمونیاک بر اثر افزایش دما متوجه میشویم که واکنش در جهت برگشت جابهجا شده است.
پ) مقدار ثابت تعادل آن در سه دمای 25 ، 200 و 400 درجه سلسیوس به صورت زیر است.
K1 = 6/2 × 10-4 , K2 = 2/24 , K3 = 6/0 × 105
کدام یک، ثابت تعادل را در دمای اتاق نشان میدهد؟ توضیح دهید.
پاسخ: K1 ، مطابق نمودار در دمای اتاق درصد مولی آمونیاک بسیار ناچیز است، پس واکنش پیشرفت کمی داشته و K تعادل باید بسیار کوچک باشد.
قبلی: جواب خود را بیازمایید صفحه ۱۰۷ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۰۵ شیمی دوازدهم
جواب باهم بیندیشیم صفحه ۱۰۴ و ۱۰۵ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۰۳ و ۱۰۴ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۰۲ شیمی دوازدهم
توجه: شما دانش آموز پایه دوازدهم رشته های نظری ریاضی فیزیک و تجربی می توانید برای دسترسی سریع و آسان تر به جواب تمرینات و سوالات فصل های اول تا چهارم کتاب شیمی دوازدهم متوسطه دوم ، در انتهای عنوان خود عبارت «ماگرتا» را نیز در گوگل جستجو کنید.
✅ در انتها امیدواریم که مقاله توضیح و جواب سوال های باهم بیندیشیم صفحه ۱۰۸ و ۱۰۹ فصل چهارم شیمی دوازدهم تجربی و ریاضی ؛ برای شما دانش آموزان عزیز مفید بوده باشد. سوالات خود را در بخش نظرات بیان کنید.