جواب خود را بیازمایید صفحه ۱۱۰ شیمی دوازدهم تجربی و ریاضی ؛ در این مقاله به پاسخ و جواب سوالات تمرین خودرابیازمایید صفحه ی 110 فصل چهارم شیمی راهی به سوی آیندهای روشن کتاب شیمی دوازدهم تجربی و ریاضی فیزیک متوسطه دوم پرداخته ایم. در ادامه با بخش آموزش و پرورش ماگرتا همراه ما باشید.
بعدی: جواب خود را بیازمایید صفحه ۱۱۲ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۱۴ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۱۶ شیمی دوازدهم
جواب باهم بیندیشیم صفحه ۱۱۷ شیمی دوازدهم
جواب در میان تارنماها صفحه ۱۱۹ شیمی دوازدهم

پاسخ و حل خود را بیازمایید صفحه ۱۱۰ شیمی دوازدهم تجربی و ریاضی
با توجه به شکل زیر که شمایی از فناوری تولید آمونیاک به روش هابر را نشان میدهد به پرسشها پاسخ دهید.
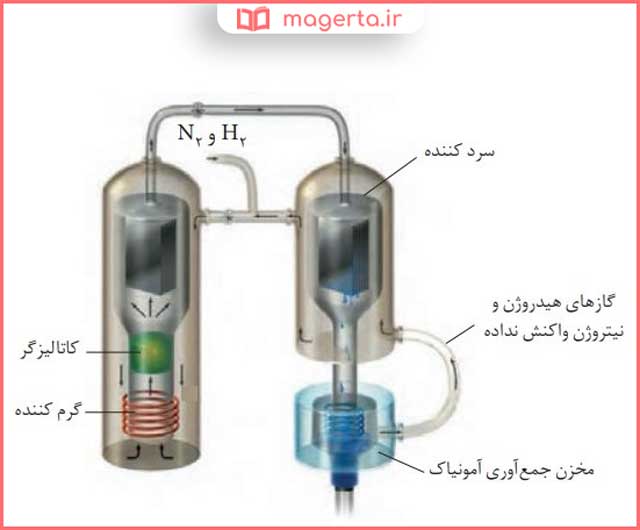
آ) در مورد روش کار هابر در این فناوری با یکدیگر گفتوگو کنید.
پاسخ: دمای بهینه با حضور کاتالیزگر برای انجام واکنش تولید آمونیاک 450 درجه سانتی گراد است، بنابراین با استفاده از یک گرم کننده این دما را تامین می کنند. همچنین برای جدا سازی آمونیاک باید مخلوط واکنش را سرد کرد. بنابراین از سیستم سرد کننده جهت کاهش دما استفاده می شود. با خروج آمونیاک از محفظهی واکنش ندادهاند را دوباره به محفظهی واکنش بر می گردانند.
پاسخ دیگر: واکنش تهیه آمونیاک از گازهای نیتروژن و هیدروژن به دلیل داشتن انرژی فعالسازی بالا در دمای اتاق امکان پذیر نیست. از این رو هابر دریافت که باید برخلاف اصل لوشاتلیه دما را بالا ببرد که در این صورت بخشی از آمونیاک تولید شده تجزیه میشود. برای افزایش غلظت آمونیاک فشار را نیز بالا برد. از آنجایی که تأمین دما و فشار بالا برای این واکنش صرفهٔ اقتصادی ندارد هابر از کاتالیزگر Fe(s) برای ایجاد شرایط بهینه استفاده کرد. با استفاده از کاتالیزگر این واکنش در دما و فشار پایینتر قابل انجام شد.
پس از تولید آمونیاک، برای افزایش درصد مولی آن، سرد کردن آمونیاک و خروج آن از سامانهٔ تعادل سبب پیشرفت واکنش در جهت رفت شده و آمونیاک بیشتری تولید میشود.
ب) اگر نقطه جوش آمونیاک، نیتروژن و هیدروژن به ترتیب 33- ، 196- و 253- درجه سلسیوس باشد، کدام دما (40- یا 200-) را برای سرد کننده مناسب میدانید؟ توضیح دهید.
پاسخ: باید دمایی انتخاب شود که در آن فقط آمونیاک به حالت مایع باید تا جداسازی راحت تر انجام شود.
40- ، زیرا در این دما آمونیاک به مایع تبدیل شده و با خروج آمونیاک مایع از سامانهٔ تعادلی، طبق اصل لوشاتلیه واکنش باید در جهت تولید آمونیاک (واکنش رفت) پیش میرود.
۲- نمودار زیر تغییر غلظت فراورده را برای واکنش تعادلی در دو شرایط متفاوت نشان میدهد.
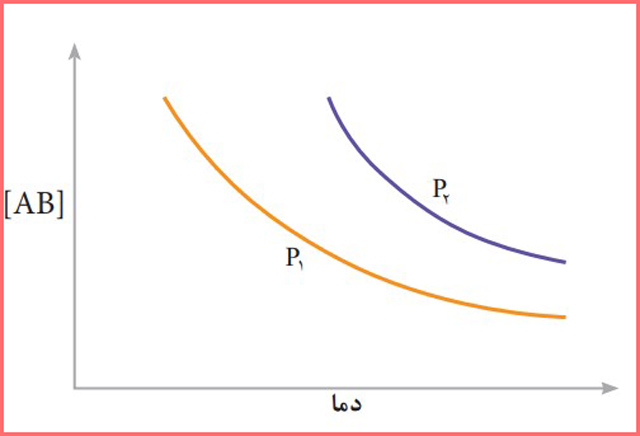
آ) این واکنش گرماده است یا گرماگیر؟ چرا؟
پاسخ: این واکنش گرماگیر است؛ زیرا: «هنگامی که دمای یک سامانه تعادلی افزایش مییابد، واکنش در جهت مصرف گرما پیش میرود، اگر این واکنش گرماگیر باشد مقدار واکنش دهنده در سامانه کاهش مییابد.»
ب) فشار P2 از P1 بزرگ تر است یا کوچک تر؟ پاسخ خود را توضیح دهید.
پاسخ: در این واکنش تعادلی در دمای ثابت، افزایش غلظت فرآورده باعث می شود افزایش فشار می شودو برعکس با افزایش فشار، میزان غلظت گاز بیشتر می شود؛ بنابراین فشار P2 از P1 بزرگ تر است.
قبلی: جواب باهم بیندیشیم صفحه ۱۰۸ و ۱۰۹ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۰۷ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۰۵ شیمی دوازدهم
جواب باهم بیندیشیم صفحه ۱۰۴ و ۱۰۵ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۱۰۳ و ۱۰۴ شیمی دوازدهم
توجه: شما دانش آموز پایه دوازدهم رشته های نظری ریاضی فیزیک و تجربی می توانید برای دسترسی سریع و آسان تر به جواب تمرینات و سوالات فصل های اول تا چهارم کتاب شیمی دوازدهم متوسطه دوم ، در انتهای عنوان خود عبارت «ماگرتا» را نیز در گوگل جستجو کنید.
✅ در انتها امیدواریم که مقاله توضیح و جواب سوال های خود را بیازمایید صفحه ۱۱۰ فصل چهارم شیمی دوازدهم تجربی و ریاضی ؛ برای شما دانش آموزان عزیز مفید بوده باشد. سوالات خود را در بخش نظرات بیان کنید.