جواب خود را بیازمایید صفحه ۷۴ و ۷۵ شیمی یازدهم تجربی و ریاضی ؛ در این مقاله به پاسخ و جواب سوالات تمرین خودرابیازمایید صفحه ی 74 و 75 فصل دوم در پی غذای سالم کتاب شیمی یازدهم تجربی و ریاضی فیزیک متوسطه دوم پرداخته ایم. در ادامه با بخش آموزش و پرورش ماگرتا همراه ما باشید.
همچنین بخوانید: جواب در میان تارنماها صفحه ۷۲ شیمی یازدهم

پاسخ و حل خود را بیازمایید صفحه ۷۴ و ۷۵ شیمی یازدهم تجربی و ریاضی
۱- هیدروژن پر اکسید (H2O2) مادهای است که با نام تجاری آب اکسیژنه به فروش میرسد.
الف) با استفاده از واکنشهای ترموشیمیایی زیر، آنتالپی واکنش H2(g) + O2(g) → H2O2(l) را حساب کنید.

پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:

ب) توضیح دهید چرا تهیهٔ این ماده از واکنش مستقیم گازهای هیدروژن و اکسیژن ممکن نیست؟
پاسخ: این واکنش، دو مرحلهای است و دارای یک گونهی حد واسط (H2O(l)) میباشد. بنابراین مطابق مکانیسم پیشنهادی برای این واکنش، ابتدا آب تشکیل شده و سپس آب اکسیژنه تشکیل میشود.
۲- در شیمی دهم آموختید که گازهای آلاینده مانند NO و CO از اگزوز خودروها به هواکره وارد میشوند. شیمیدانهای هواکره انجام واکنش زیر را برای تبدیل این آلایندهها به گازهایی پایدارتر و با آلایندگی کمتر، طراحی کردهاند.
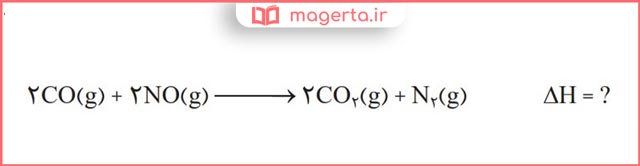
آنتالپی واکنش بالا را با استفاده از واکنشهای ترموشیمیایی زیر حساب کنید.

پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:

۳- واکنش سوختن کامل گرافیت را میتوان مجموعهای از دو واکنش پی درپی مطابق نمودار زیر دانست.
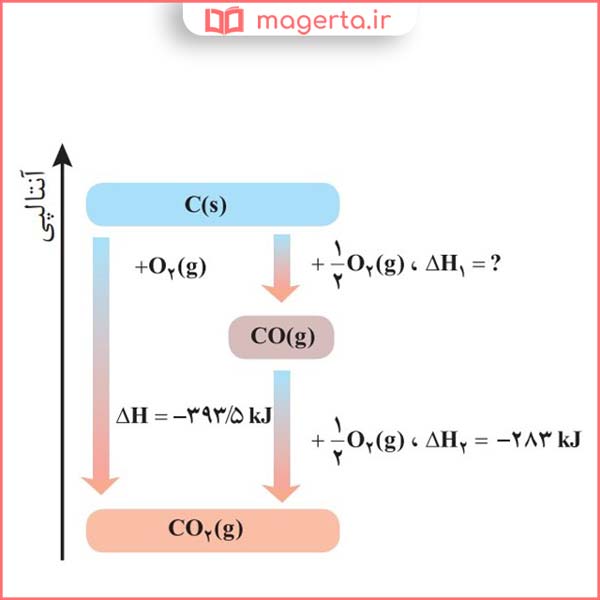
الف) شواهد نشان میدهد که ΔH واکنش تولید CO(g) را نمیتوان به روش تجربی تعیین کرد. دربارۀ علت آن گفتوگو کنید.
پاسخ: گاز CO2 پایدارتر از گاز CO است به همین جهت از واکنش گرافیت با گاز اکسیژن محصول پایدارتر کربن دی اکسید حاصل می شود.
ب) ΔH واکنش تولید CO(g) را از گرافیت و گاز اکسیژن حساب کنید.
پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:

۴- شواهد تجربی نشان میدهند که تهیۀ آمونیاک به روش هابر از گازهای نیتروژن و هیدروژن مطابق نمودار زیر یک واکنش دو مرحلهای است.
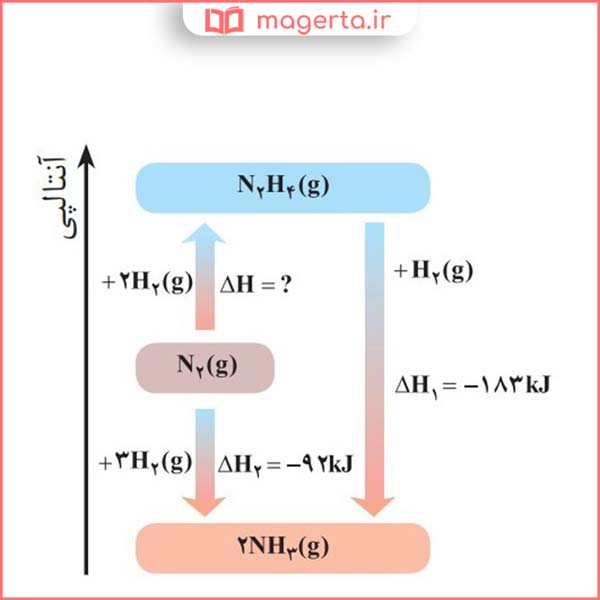
الف) در شرایط یکسان، هیدرازین پایدارتر است یا آمونیاک؟ چرا؟
پاسخ: آمونیاک پایدارتر از هیدرازین است. زیرا محتوای انرژی آن پایین تر از هیدرازین است.
ب) آنتالپی واکنش تولید هیدرازین را حساب کنید.
پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:

همچنین بخوانید: جواب خود را بیازمایید صفحه ۷۱ و ۷۲ شیمی یازدهم
و
جواب خود را بیازمایید صفحه ۶۹ و ۷۰ شیمی یازدهم
توجه: شما دانش آموز پایه یازدهم رشته های نظری ریاضی فیزیک و تجربی می توانید برای دسترسی سریع و آسان تر به جواب تمرینات و سوالات فصل های اول و دوم و سوم کتاب شیمی یازدهم متوسطه دوم ، در انتهای عنوان خود عبارت «ماگرتا» را نیز در گوگل جستجو کنید.
✅ در انتها امیدواریم که مقاله توضیح و جواب سوال های خودرابیازمایید صفحه ۷۴ و ۷۵ فصل دوم شیمی یازدهم تجربی و ریاضی ؛ برای شما دانش آموزان عزیز مفید بوده باشد. سوالات خود را در بخش نظرات بیان کنید.













سوالات فصل دو شیمی رو می خواستم خیلی ممنون.