جواب خود را بیازمایید صفحه ۳۳ و ۳۴ شیمی دهم تجربی و ریاضی ؛ در این مقاله به پاسخ و جواب سوالات تمرین خودرابیازمایید صفحه ی 33 و 34 فصل اول کیهان زادگاه الفبای هستی کتاب شیمی دهم تجربی و ریاضی فیزیک متوسطه دوم پرداخته ایم. در ادامه با بخش آموزش و پرورش ماگرتا همراه ما باشید.
بعدی: جواب خود را بیازمایید صفحه ۳۵ شیمی دهم
جواب با هم بیندیشیم صفحه ۳۷ و ۳۸ شیمی دهم
جواب با هم بیندیشیم صفحه ۳۸ و ۳۹ شیمی دهم
جواب خود را بیازمایید صفحه ۴۱ شیمی دهم
جواب تمرین های دوره ای فصل اول شیمی دهم

پاسخ و حل خود را بیازمایید صفحه ۳۳ و ۳۴ شیمی دهم تجربی و ریاضی
۱) آ) با مراجعه به جدول دوره ای عنصرها، جدول زیر را کامل کنید.
پاسخ: پاسخ این پرسش را می توانید در تصویر زیر مشاهده کنید:

ب) جدول زیر را کامل کنید.
پاسخ: پاسخ این پرسش را می توانید در تصویر زیر مشاهده کنید:
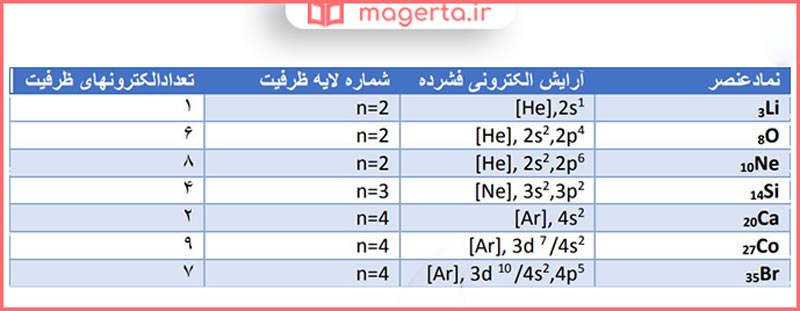
پ) از روی آرایش الکترونی اتم هر عنصر میتوان موقعیت آن را در جدول تعیین کرد، برای این منظور:
⚫️ شماره بیرونیترین لایه را با شماره دوره این عنصرها مقایسه کنید. از این مقایسه چه نتیجهای میگیرید؟
پاسخ: شماره دوره همان شماره لایه ظرفیت است. عناصری که آرایش الکترونی آنها به (3d) ختم میشود در دورهی چهارم جای دارند.
⚫️ شماره گروه کدام عنصرها با تعداد الکترونهای ظرفیت آنها برابر است؟
پاسخ: گروه ۱ تا ۱۲ که شامل گروه های ۳Li و ۲۰Ca و ۲۷Co
⚫️ شماره گروه کدام عنصرها با تعداد الکترونهای ظرفیت آنها برابر نیست؟ در این حالت بین شماره گروه و تعداد الکترونهای ظرفیت چه رابطهای هست؟ توضیح دهید.
پاسخ: گروه ۱۳ تا ۱۸ که شامل گروه های 8O و ۱۰Ne و ۱۴Si و ۳۵Br
عناصری که زیر لایه (s و d) آنها در حال پر شدن است شمارهی گروه با تعداد الکترونهای ظرفیتی آنها برابر است.
عناصری که زیر لایه (p) آنها در حال پر شدن میباشد با اضافه کردن عدد ۱۰ بر تعداد الکترونهای ظرفیتی میتوان به شمارهی گروه این عناصر پی برد.
⚫️ برای عنصرهای دسته d، شماره دوره و گروه را چگونه میتوان از روی آرایش الکترونی به دست آورد؟ توضیح دهید.
پاسخ: عناصر دستهی (d) دارای شمارهی دوره (n+1) هستند. برای مثال اگر آرایش الکترونی زیر لایه به 3d7 ختم شود، دوره آن عبارت است از (4=1+3) و برای به دست آوردن شماره گروه میتوان تعداد الکترون ظرفیت را منظور کرد (به جز عناصر کروم و مس که دارای آرایش الکترونی استثناء بوده و به ترتیب در گروههای 6 و 11 جدول تناوبی جای دارند.
٢) موقعیت عنصرهای کربن (6C)، آلومینیم (13AI)، آهن (26Fe) و روی (30Zn) را در جدول دوره ای عنصرها تعیین کنید.
پاسخ: پاسخ این پرسش را می توانید در تصویر زیر مشاهده کنید:

۳) عنصرهای جدول دورهای را میتوان در چهار دسته به صورت زیر جای داد، اساس این دسته بندی را توضیح دهید.
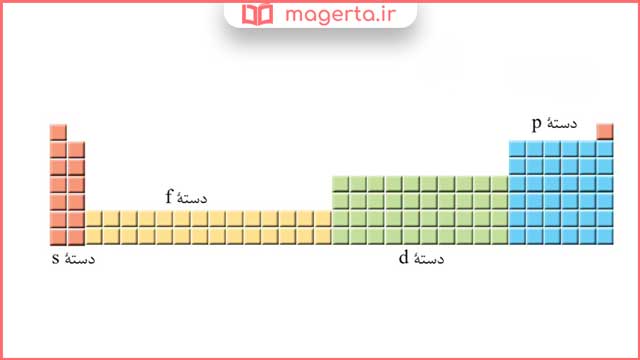
پاسخ: عناصر جدول تناوبی در چهار دستهی s, p , d , f قرار میگیرند. طبق اصل آفبا، بر اساس آرایش الکترونی لایه ظرفیت و بیرونیترین زیرلایه، اتمها را در دوره و گروههای مشخص طبقه بندی میکنند. عناصری که در هر گروه از جدول قرار دارند دارای آرایش الکترونی لایه ظرفیت مشابهی هستند.
قبلی: جواب خود را بیازمایید صفحه ۳۲ شیمی دهم
جواب باهم بیندیشیم صفحه ۲۸ و ۲۹ شیمی دهم
جواب خود را بیازمایید صفحه ۲۳ شیمی دهم
جواب خود را بیازمایید و کاوش کنید صفحه ۲۱ شیمی دهم
جواب خود را بیازمایید صفحه ۱۹ شیمی دهم
جواب پیوند با ریاضی صفحه ۱۷ شیمی دهم
توجه: شما دانش آموز پایه دهم رشته های نظری ریاضی فیزیک و تجربی می توانید برای دسترسی سریع و آسان تر به جواب تمرینات و سوالات فصل های اول و دوم و سوم کتاب شیمی دهم متوسطه دوم ، در انتهای عنوان خود عبارت «ماگرتا» را نیز در گوگل جستجو کنید.
✅ در انتها امیدواریم که مقاله توضیح و جواب سوال های خود را بیازمایید صفحه ۳۳ و ۳۴ فصل اول شیمی دهم تجربی و ریاضی ؛ برای شما دانش آموزان عزیز مفید بوده باشد. سوالات خود را در بخش نظرات بیان کنید.















برای آرایش الکترونی fe اون آخرشو اشتباه نوشتین باید 3d⁶ باشه نه ۳p⁶
مرسی❤️