جواب تمرین های دوره ای صفحه ۳۳ ، ۳۴ ، ۳۵ و ۳۶ فصل اول شیمی دوازدهم ؛ در این مقاله به پاسخ و جواب سوالات تمرین های دوره ای صفحه ی 33 و 34 و 35 و 36 فصل 1 اول مولکول ها در خدمت تندرستی کتاب شیمی دوازدهم تجربی و ریاضی فیزیک متوسطه دوم پرداخته ایم. در ادامه با بخش آموزش و پرورش ماگرتا همراه ما باشید.
بعدی: جواب باهم بیندیشیم صفحه ۴۰ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۴۲ شیمی دوازدهم
جواب در میان تارنماها صفحه ۴۲ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۴۳ شیمی دوازدهم
جواب باهم بیندیشیم صفحه ۴۵ شیمی دوازدهم

پاسخ و حل تمرین های دوره ای فصل ۱ اول شیمی دوازدهم صفحه ۳۳ ، ۳۴ ، ۳۵ و ۳۶
۱- برای هر یک از موارد زیر دلیلی بیاورید.
آ) اسیدها و بازها با ثابت یونش کوچک، الکترولیت ضعیف به شمار میروند.
پاسخ: ثابت یونش کوچک نشان دهنده میزان یونش کم و غلظت کم یونها در محلول است.
ب) اغلب اسیدها و بازهای شناخته شده ضعیف هستند.
پاسخ: اغلب اسیدهای شناخته شده (آلی و معدنی) ضعیف هستند به طوری که مصرف خوراکیها داروها و همچنین استفاده از بسیاری پاککنندههای گوناگون، این ویژگی را تایید میکند.
پ) در محلول 0/1 مولار نیتریک اسید در دمای اتاق، است.
پاسخ: نیتریکاسید، یک اسید قوی است (Ka بزرگ). بزرگ). از این رو در محلول آن، یونش به طور کامل رخ میدهد و به ازای یونش هر HNO3 در محلول، یک هیدرونیوم و یک یون نیترات تولید میشود. پس:
[HNO3] = [H+] = [NO–3] = 0/1 molL-1
ت) در محلول 0/01 مولار از فورمیک اسید [+H] < [HCOOH] است.
پاسخ: فورمیکاسید یک اسید ضعیف است (4-10 × 1/8 = Ka). از این رو در محلول به طور جزئی یونیده میشود در واقع مولکولهای HCOOH به طور عمده به شکل یونیده نشده در محلول وجود دارند.
۲- کاغذ PH بر اثر آغشته شدن به نمونهای از یک محلول، به رنگ سرخ در میآید. همچنین رسانایی الکتریکی این محلول در شرایط یکسان به طور آشکاری از محلول آبی سدیم کلرید کمتر است. این محلول محتوی کدام ماده حل شونده میتواند باشد؟ توضیح دهید.
CH3OH , KBr , KOH , HCOOH , HCl , NH3
پاسخ: رنگ سرخ کاغذ PH رنگ سرخ کاغذ نشانه اسیدی بودن محلول است. رسانایی الکتریکی کم آن، محلول الکترولیت ضعیف را یادآوری میکند. این ویژگیهای محلول یک اسید ضعیف است که با HCOOH(aq) همخونی دارد. HCl و KOH و KBr الکترولیتهای قوی بوده اما CH3OH غیر الکترولیت است. NH3 با اینکه الکترولیت ضعیف است اما محلول آبی آن خاصیت بازی دارد.
۳- در دما و غلظت یکسان، هر یک از شکلهای زیر به کدام یک از محلولها تعلق دارد؟ چرا؟
آ) محلول استیک اسید (5-10 × 1/8 = Ka)
ب) محلول هیدروبرمیک اسید (Ka بسیار بزرگ)
پ) محلول هیدروسیانیک اسید (10-10 × 4/9 = Ka)
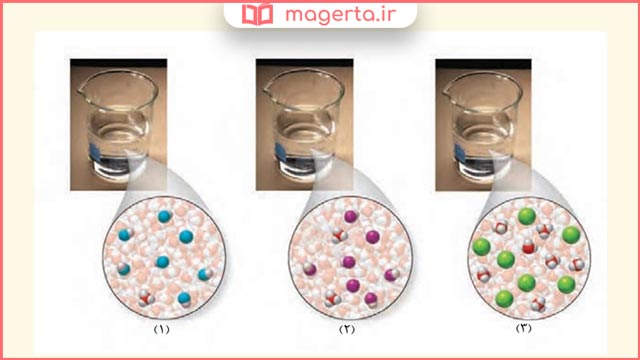
پاسخ: بر اساس مقدار ثابت یونش محلول (۴) با هیدروبرمیک اسید، محلول (۳) با استیک اسید، و محلول (۱) با هیدروسیانیک اسید همخوانی دارد. زیرا برای اسیدهای تک پروتون دار هرچه غلظت یون هیدرونیوم بیشتر باشد ، ثابت یونش بزرگتر است.
۴- رنگ گل ادریسی به میزان اسیدی بودن خاک بستگی دارد. این گل در خاکی که غلظت یون هیدرونیوم آن 5-10 × 2 است به رنگ آبی اما در خاک دیگری که غلظت یون هیدرونیوم 9-10 × 4 است به رنگ سرخ شکوفا میشود. PH این دو نوع خاک را حساب کنید.

پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:

۵- به شکل (آ) توجه کنید:
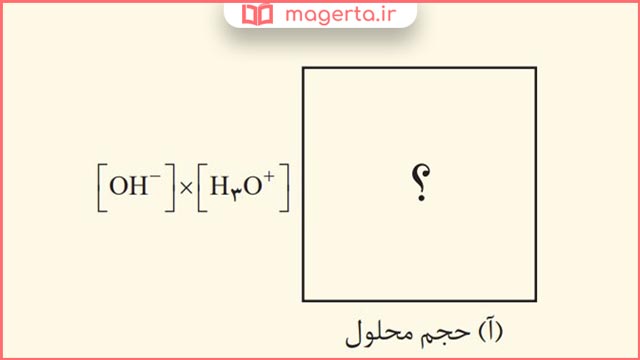
دانش آموزی برای نشان دادن ارتباط بین حاصل ضرب غلظت یونهای هیدرونیوم و هیدروکسید با حجم محلول، شکلهای آ تا پ را پیشنهاد داده است. کدام یک از این شکلها ارتباط بین کمیتهای داده شده را به درستی نشان میدهد؟
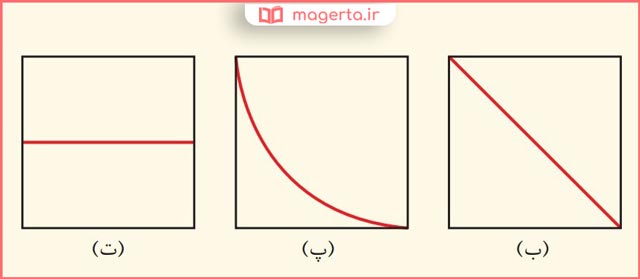
پاسخ: با توجه به اینکه در دمای ثابت برای محلولهای آبی حاصل ضرب [–OH][+H] همواره مقدار ثابتی است، از اینرو با تغییر حجم محلول، حاصل ضرب غلظت این یونها ثابت میماند در واقع نمودار (ت) برای این توصیف مناسب است.
۶- در نمونهای از عصاره گوجه فرنگی، غلظت یون هیدرونیوم 6-10 × 4 برابر غلظت یون هیدروکسید است. PH آن را حساب کنید و در جای خالی بنویسید.

پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:

۷- PH یک نمونه از آب سیب برابر با 4/7 است. نسبت غلظت یونهای هیدرونیوم به یونهای هیدروکسید را در این نمونه حساب کنید.
پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:
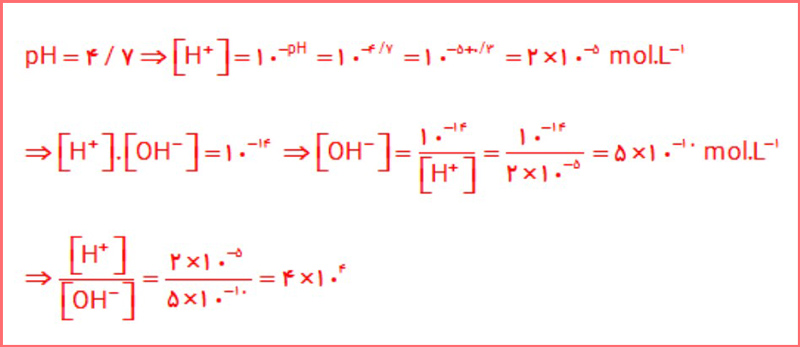
۸- هر یک از شکلهای زیر 500 میلی لیتر از محلول آبی یک حل شونده را نشان میدهد.

آ) این حل شوندهها اسید آرنیوس هستند یا باز آرنیوس؟ چرا؟
پاسخ: اسید آرنیوس، زیرا با حل شدن در آب باعث افزایش غلظت یون هیدرونیوم شدهاند.
ب) درجه یونش و PH را برای هر یک از آنها حساب کنید (هر ذره را 0/001 مول از آن گونه در نظر بگیرید).
پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:

۹- HX و HY دو اسید ضعیف هستند. اگر 12 گرم از HX و 8 گرم از HY جداگانه در یک لیتر آب حل شوند، PH این دو محلول برابر خواهد شد. با مقایسه درجه یونش آنها مشخص کنید کدام اسید قویتری است؟ چرا؟
پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:

۱۰- یک کارشناس شیمی، pH نمونههایی از ۲۰۰ لیتر محلول تهیه شده (۱ و ۲) را اندازهگیری کرده است. حساب کنید، چه جرمی از هر ماده حلشونده به ۲۰۰ لیتر آب افزوده شده است؟ از تغییر حجم چشمپوشی کنید.

پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:

۱۱- با توجه به شکل زیر که نمای ذرهای از یک واکنش را نشان میدهد، به پرسشها پاسخ دهید.
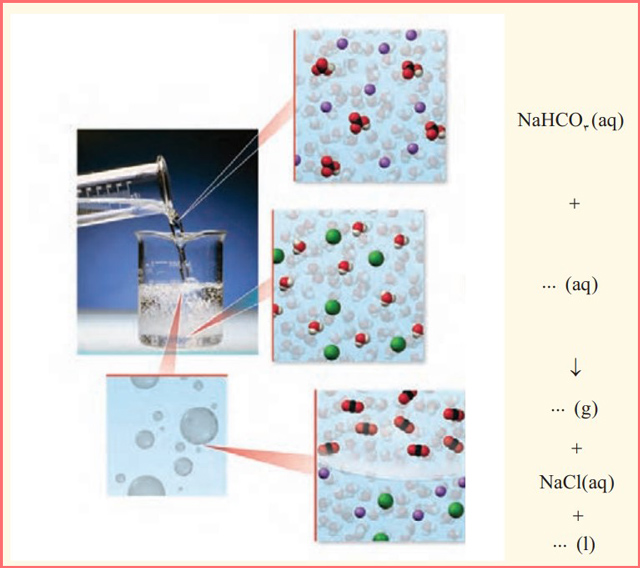
آ) هر یک از جاهای خالی را با فرمول شیمیایی مناسب پر کنید.
پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:
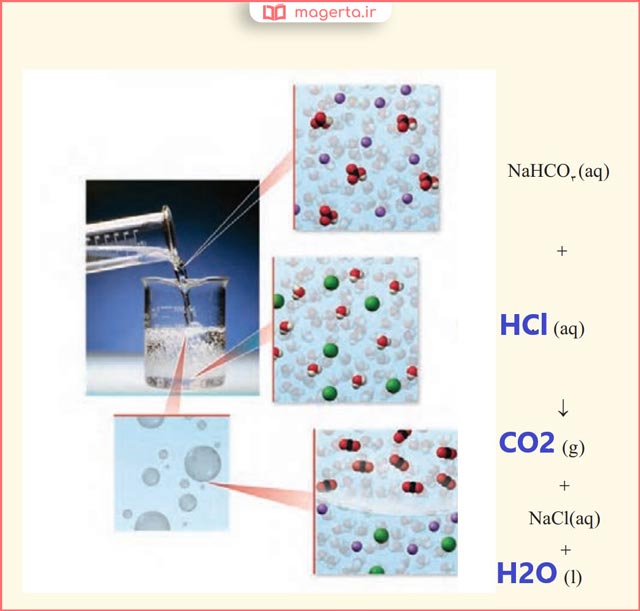
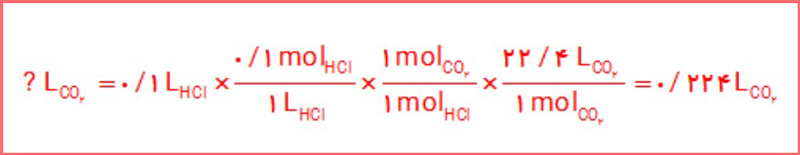
ب) از واکنش 100 میلی لیتر از محلول هیدروکلریکاسید 0/2 مول بر لیتر با مقدار کافی از سدیم هیدروژن کربنات چند لیتر گاز کربن دی اکسید در STP تولید میشود؟
پاسخ: در تصویر زیر می توانید پاسخ این پرسش را مشاهده کنید:
۱۲- ثابت یونش برای محلولهای BOH(aq) و B’OH(aq) در دمای اتاق به ترتیب برابر با 5-10 × 1/8 و 4-10 × 4/8 است.
آ) کدامیک باز قویتری است؟ چرا؟
پاسخ: B’OH(aq) باز قوی تری است – زیرا دارای ثابت یونش بزرگتری می باشد.
پاسخ دیگر: می دانیم که هرچه ثابت یونش یک باز بیشتر باشد، باز قوی تر خواهد بود. در نتیجه محلول B’OH باز قوی تر است.
ب) pH کدام محلول کمتر است؟ چرا؟
پاسخ: BOH(aq) دارای pH کمتری است – زیرا باز ضعیف تری می باشد. به بیانی دیگر هر چه تعداد [+H] بیشتر باشد، باز ضعیف تر خواهد شد.
پاسخ دیگر: محلول BOH باز ضعیفی است. در نتیجه غلظت یون هیدرونیوم آن به مراتب از محلول دیگری بیشتر است. در نتیجه pH کمتری دارد.
قبلی: جواب خود را بیازمایید صفحه ۳۲ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۲۹ و ۳۰ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۲۸ شیمی دوازدهم
جواب باهم بیندیشیم صفحه ۲۶ و ۲۷ شیمی دوازدهم
جواب پیوند با ریاضی صفحه ۲۴ و ۲۵ شیمی دوازدهم
توجه: شما دانش آموز پایه دوازدهم رشته های نظری ریاضی فیزیک و تجربی می توانید برای دسترسی سریع و آسان تر به جواب تمرینات و سوالات فصل های اول تا چهارم کتاب شیمی دوازدهم متوسطه دوم ، در انتهای عنوان خود عبارت «ماگرتا» را نیز در گوگل جستجو کنید.
✅ در انتها امیدواریم که مقاله توضیح و جواب سوال های تمرین های دوره ای صفحه ۳۳ ، ۳۴ ، ۳۵ و ۳۶ فصل ۱ اول شیمی دوازدهم تجربی و ریاضی ؛ برای شما دانش آموزان عزیز مفید بوده باشد. سوالات خود را در بخش نظرات بیان کنید.















سوال ۸ غلط محاسباتتون
سلام، ممنون از شما مورد گفته شده را اصلاح کردیم.
مثل همیشه چندین سوال رو غلط زده بودین
سلام، کدوم یک از سوالها مشکل دارند؟ تا براتون اصلاحشون کنیم.
سلام خیلی سایت خوبیه 👌🏻👌🏻
سلام سوال 11 … اول مقدار مول HCL رو با فرمول غلظت مولی بدست بیارین بعد استوکیومتری رو شروع کنین .
حاجی دمت/دمتون گرم
سلام تمرین شماره ۷ محسبات ph ظاهرا اشتباه حساب کردین
دمتون گرم عالی بود
دمتون گرم عالییییییییییییییییییییییییییی
It’s so perfect and OK 👍 👌 I like it 👌 😀
عااااااالی بود 😻♥️
سلام خسته نباشید جواب سوال ۷ کامل نیست . چون غلظت هیدرونیوم خالی رو نخواسته بلکه نسبت غلظتش به هیدروکسید رو خواسته