جواب تمرین های دوره ای صفحه ۶۳ ، ۶۴ ، ۶۵ و ۶۶ فصل دوم شیمی دوازدهم ؛ در این مقاله به پاسخ و جواب سوالات تمرین های دوره ای صفحه ی 63 ، 64 ، 65 و 66 فصل 2 دوم آسایش و رفاه در سایه شیمی کتاب شیمی دوازدهم تجربی و ریاضی فیزیک متوسطه دوم پرداخته ایم. در ادامه با بخش آموزش و پرورش ماگرتا همراه ما باشید.
بعدی: جواب خود را بیازمایید صفحه ۶۹ شیمی دوازدهم
جواب باهم بیندیشیم صفحه ۷۰ و ۷۱ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۷۱ و ۷۲ شیمی دوازدهم
جواب در میان تارنماها صفحه ۷۳ شیمی دوازدهم
جواب کاوش کنید صفحه ۷۳ شیمی دوازدهم

پاسخ و حل تمرین های دوره ای فصل ۲ دوم شیمی دوازدهم صفحه ۶۳ ، ۶۴ ، ۶۵ و ۶۶
۱- برای هر یک از جملههای زیر، دلیلی بنویسید.
آ) فلز پلاتین را میتوان در بخشهای مختلف بدن هنگام جراحی به کار برد.
پاسخ: فلز پلاتین جزوفلزهای نجیب است. این فلز به دلیل داشتن E۰ بزرگ، تمایلی برای از دست دادن الکترون و شرکت در واکنشهای شیمیایی ندارد، بنابراین با الکترولیتها مواد موجود در بدن واکنش نمیدهد.
پاسخ دیگر: پلاتین فلزی با واکنش پذیری کم و 1/20+ = E۰ می تواند در بدن برای مدت های طولانی ویژگی های خود را حفظ کند.
ب) فلوئور، اكسندهترین عنصر در جدول دورهای است.
پاسخ: فلوئور به عنوان فعالترین نافلز جدول دورهای تمایلی به دادن الکترون ندارد، بلکه تمایل بسیار زیاد برای گرفتن الکترون و کاهش یافتن دارد، بنابراین قدرت اکسندگی زیادی هم دارد.
E۰(F2/F) = +2/8 V
پاسخ دیگر: با توجه به شعاع و آرایش الکترونی فلوئور، تمایل اتم آن برای دریافت و یا کشیدن الکترون های موجود در یک پیوند بالا بوده (بالاترین تمایل به گرفتن الکترون نسبت به سایر عناصر)؛ بنابراین اکسنده ترین گونه در جدول پتانسیل کاهشی است.
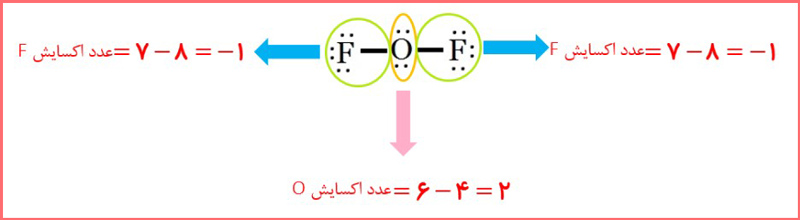
پ) عدد اکسایش اکسیژن در OF2 برابر با 2+ است.
پاسخ: در تصویر زیر می توانید پاسخ این بخش را مشاهده کنید:
۲- با مراجعه به جدول ۱، توضیح دهید کدام نمودار تغییر غلظت یونها را در سلول گالوانی روی ــ مس نشان میدهد.
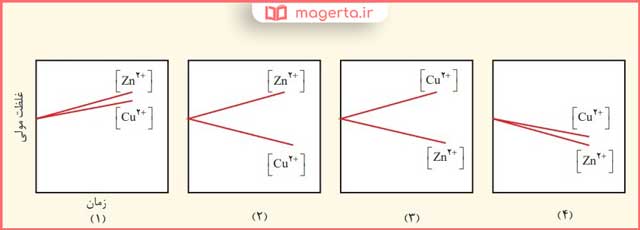
پاسخ: در نمودار شماره (۲)، پتانسیل کاهشی مس بیشتر از روی است، بنابراین در سلول گالوانی مس از نوع کاتد و روی از نوع آند است. با گذشت زمان از غلظت یونهای دو بار مثبت مس در کاتد کم می شود و بر غلظت یونهای رو دو بار مثبت در آند افزوده می شود.
پاسخ دیگر: از آنجایی که پتانسیل کاهشی مس بزرگتر از پتانسیل کاهشی روی است، بنابراین در سلول گالوانی، روی آند و مس کاتد است. بنابراین با گذشت زمان از غلظت یون های دو بار مثبت مس در کاتد کاسته و بر غلظت یون های روی دو بار مثبت در آند افزوده می شود. بنابراین نمودار (۲) تغییر غلظت را به درستی نشان می دهد.
۳- emf سلولی که واکنش زیر در آن رخ میدهد برابر با 1/98V است. E۰ نیم سلول A را حساب کرده و با مراجعه به جدول مشخص کنید A کدام فلز است؟
A(s) + 2Ag+(aq) → A2+(aq) + 2Ag(s)
پاسخ: در تصویر زیر می توانید پاسخ این بخش را مشاهده کنید:

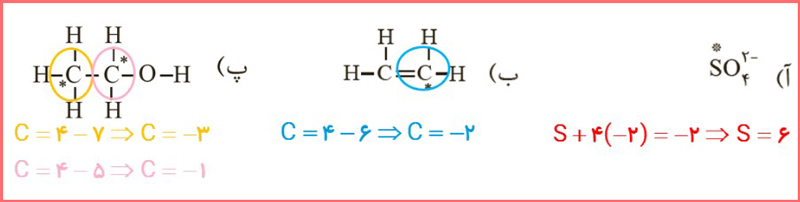
۴- عدد اکسایش اتم نشان داده شده با ستاره را مشخص کنید.
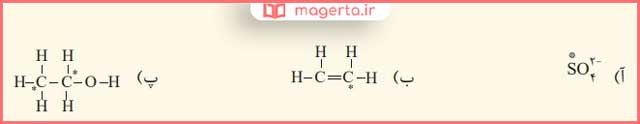
پاسخ: در تصویر زیر می توانید پاسخ این بخش را مشاهده کنید:
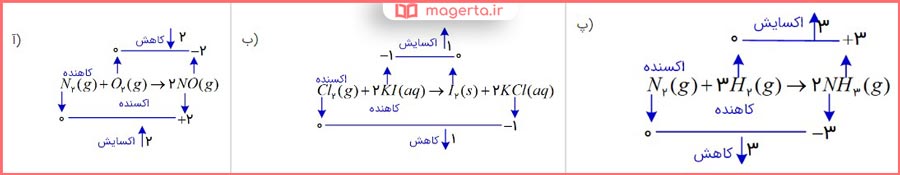
۵- در هر یک از واکنشهای زیر گونههای اکسنده و کاهنده را مشخص کنید.

پاسخ: در تصویر زیر می توانید پاسخ این بخش را مشاهده کنید:
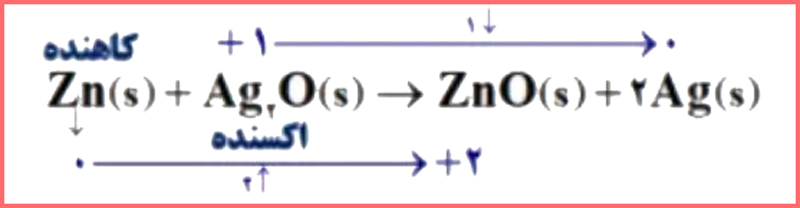
۶- باتریهای روی ــ نقره از جمله باتریهای دگمهای هستند که در آنها واکنش زیر انجام میشود.
Zn(s) + Ag2O(s) → ZnO(s) + 2Ag(s)
آ) گونههای اکسنده و کاهنده را در آن مشخص کنید.
پاسخ: در تصویر زیر می توانید مشاهده کنید:
ب) آند و کاتد را در این باتری مشخص کنید.
پاسخ: آند: روی (Zn) – کاتد: نقره (Ag) (در تصویر زیر هم می توانید مشاهده کنید:)
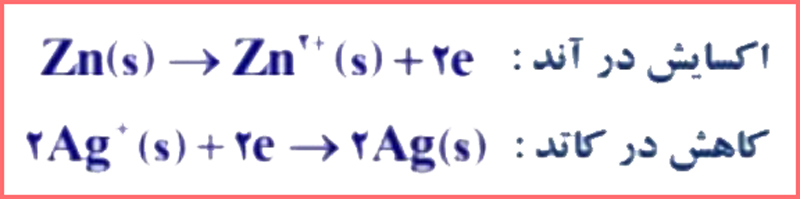
پاسخ دیگر: در این باتری ها آند به عنوان قطب منفی (-) یعنی Ag و کاتد را به عنوان قطب مثبت (+) یعنی Zn است.
۷) با توجه به جدول زیر به پرسشها پاسخ دهید.
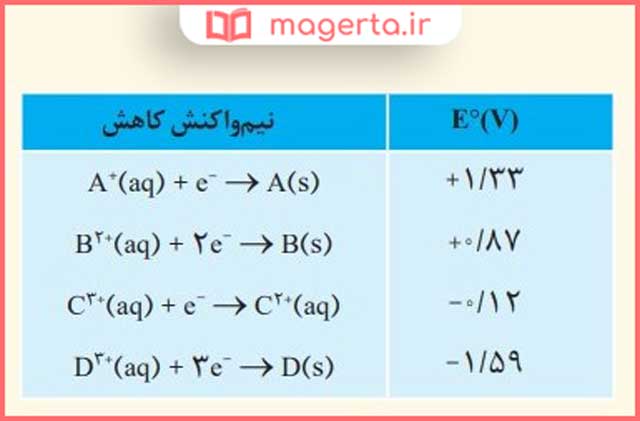
آ) کدام گونه قویترین و کدام ضعیفترین اکسنده است؟
پاسخ: برای مقایسه اکسندهها گونههای سمت چپ را نگاه می کنند، هر چه پتانسیل کاهشی مثبت تر باشد، اکسنده قوی تری است:
قویترین اکسنده: A+(aq) چون بیشترین E۰ را دارد.
ضعیفترین اکسنده: D3+(aq) چون کمترین E۰ را دارد.
ب) کدام گونه قویترین و کدام ضعیفترین کاهنده است؟
پاسخ: قویترین کاهنده: D(s) – هر چه پتانسیل کاهشی یک نیم واکنش کمتر باشد، گونه سمت راست آن کاهندهی قوی تری است.
ضعیفترین کاهنده: A(s) – هر چه پتانسیل کاهشی یک نیم واکنش بزرگتر باشد، گونه سمت راست آن کاهنده ضعیف تری است.
پ) کدام گونه(ها) میتوانند +C2 را اکسید کنند؟
پاسخ: هر گونهای که پتانسیل کاهشی بیشتری نسبت به نیم واکنش کاهش +C3 داشته باشد می تواند +C2 را اکسید کند. بنابراین گونههای A+(aq) و B2+(aq) میتوانند +C2 را اکسید کنند.
۸- با توجه به واکنشهای زیر که به طور طبیعی انجام میشوند، گونههای کاهنده و گونههای اکسنده را بر حسب کاهش قدرت مرتب کنید؟

پاسخ: در تصویر زیر می توانید پاسخ این بخش را مشاهده کنید:

۹- با توجه به جدول پتانسیلهای کاهشی استاندارد توضیح دهید محلول هیدروکلریک اسید را در کدام ظرف (مسی یا آهنی) می توان نگه داشت؟
پاسخ: ظرف مسی مناسب است. به طور کلی برای نگه داری محلولها جنس ظرف باید از فلزی انتخاب شود که جایگاه آن در جدول پتانسیل کاهشی استاندارد بالاتر از کاتیون موجود در محلول باشد، پس برای نگهداری محلول رقیق اسیدها باید ظرفی را انتخاب کرد که E۰ آن را بالاتر از هیدروژن باشد. (0 < E۰)
پاسخ دیگر: E0(SHE) = 0 – از آن جا که این محلول حاوی یون های H+(aq) است که پتانسیل کاهشی این گونه نیز برابر صفر است و با توجه به جایگاه مس و آهن در جدول کاهشی و منفی بودن این عدد برای آهن می توان نتیجه گرفت آهن بر خلاف مس در مجاورت محلول اسید واکنش می دهد. به عبارتی ظرف آهنی دچار خوردگی می شود اما ظرف مسی واکنشی با محلول هیدرو کلریک اسید نمی دهد:
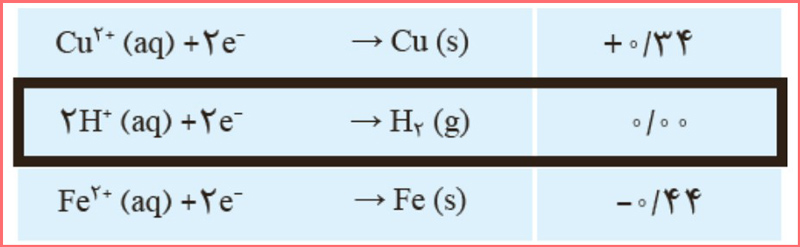
۱۰- قدر مطلق پتانسيل كاهشی دو عنصر X و Y در زير داده شده است. هنگامی که اين دو نيم سلول را به هم وصل می کنيم، جريان الكتریكی از اتم X به اتم Y برقرار می شود و با اتصال نيم سلول X به نيم سلول هيدروژن، الكترون ها از اتم X به سمت نيم سلول هيدروژن جاری می شوند. نيروی الكتروموتوری سلول گالوانی شامل اين دو نيم سلول را حساب كنيد.
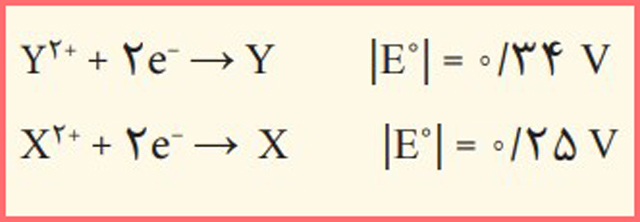
پاسخ: از عبارت «با اتصال نيم سلول X به نيم سلول هيدروژن، الكترون ها از اتم X به سمت نيم سلول هيدروژن جاری می شوند» متوجه می شویم که نیم سلول X آند محسوب می شود.
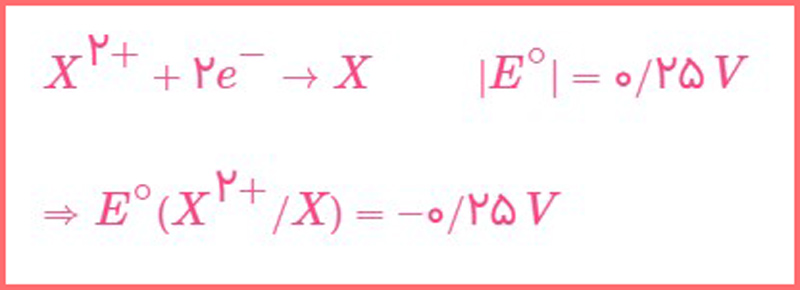
از عبارت «هنگامی که اين دو نيم سلول را به هم وصل می کنيم، جريان الكتریكی از اتم X به اتم Y برقرار می شود» متوجه می شویم که نیم سلول X آند و نیم سلول Y کاتد است؛ بنابراین:
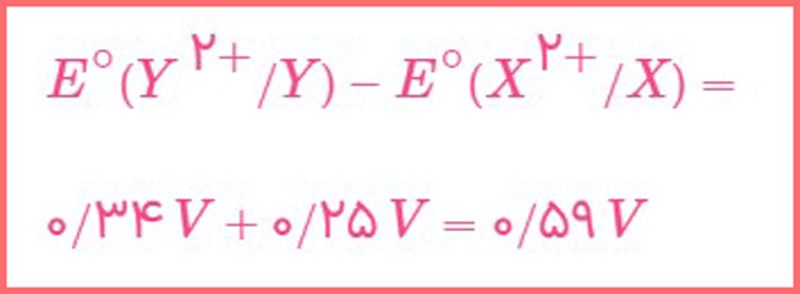
۱۱- شیمیدانها در برخی سلولهای الکتروشیمیایی برای انجام واکنش اکسایش ــ کاهش از نور بهره میبرند و آنها را سلول نور الکتروشیمیایی مینامند.
در نمونهای از آنها که برای تهیه گاز هیدروژن از آب به کار میرود، با توجه به نیم واکنشهای زیر:

آ) نیم سلول آند و کاتد را مشخص و emf سلول را حساب کنید.
پاسخ: SiO2(s) + 4H+(aq) + 4e– → Si(s) + 2H2O(l) :نیم سلول آند
2H2O(l) + 2e– → H2(g) + 2OH–(aq) :نیم سلول کاتد
emf = 0/83 – (-0/84) = 0/01 V
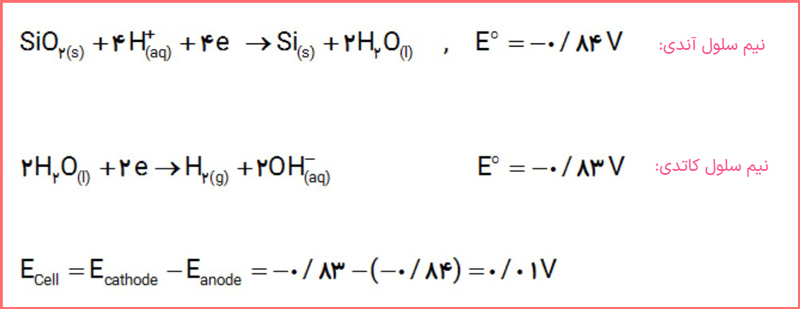
ب) یافتههای تجربی نشان میدهند که افزون بر emf، بازده و سرعت انجام واکنش در این سلول پایین است، با این توصیف چرا برخی استفاده از آنها را برای تهیه گاز هیدروژن مناسب میدانند؟
پاسخ: زیرا گاز H2 (هیدروژن)، گاز خطرناکی است و تحت کنترل تولید می شود.
پاسخ دیگر: استفاده از انرژی پاک و رایگان خورشید
آلودگی بسیار کم سوخت هیدروژن
بازدهی بالای اکسایش هیدروژن در سلولهای سوختی
انرژی زیاد هیدروژن به ازای یک گرم نسبت به سوختهای فسیلی
۱۲- در یک آزمایش چهار فلز A ، B ، C و D رفتارهای زیر را نشان دادهاند:
⚫ فقط فلزهای A و C با محلول 0/1M هیدروکلریک اسید واکنش می دهند و گاز هیدروژن تولید می کنند.
⚫ با قرار دادن فلز C در محلول های حاوی یون های به ترتیب فلزهای D، B و A رسوب می کنند.
⚫ یون +B2 اکسنده قوی تر از +D2 است.
با توجه به این داده ها، ترتیب کاهندگی این چهار فلز را مشخص کنید.
پاسخ: از بند (۱) متوجه می شویم که فلزهای A و C از دیگر فلزها کاهنده تر هستند و می توانند الکترون های خود را از دست بدهند.
از بند (۲) متوجه می شویم که فلز C از فلز A کاهنده تر است و می تواند الکترون های خود را به یون +A2 بدهد و آن را به فلز A تبدیل کند.
از بند (۳) متوجه می شویم که فلز D از فلز B کاهنده تر است.
بنابراین قدرت کاهندگی این چهار فلز به صورت زیر می باشد:
C > A > D > B
۱۳- جدول زیر نیروی الکتروموتوری سه سلول گالوانی را نشان می دهد:

اگر و فلز A با یون C+2 واکنش ندهد:
آ) مقدار پتانسیل کاهشی استاندارد را برای دو عنصر A و B به دست آورید.
پاسخ: از عبارت «فلز A با یون C+2 واکنش ندهد» متوجه می شویم که فلز A اکسنده تر از فلز C می باشد؛ در نتیجه فلز A نقش کاتد را ایفا می کند و فلز C نقش آند را؛ بنابراین:
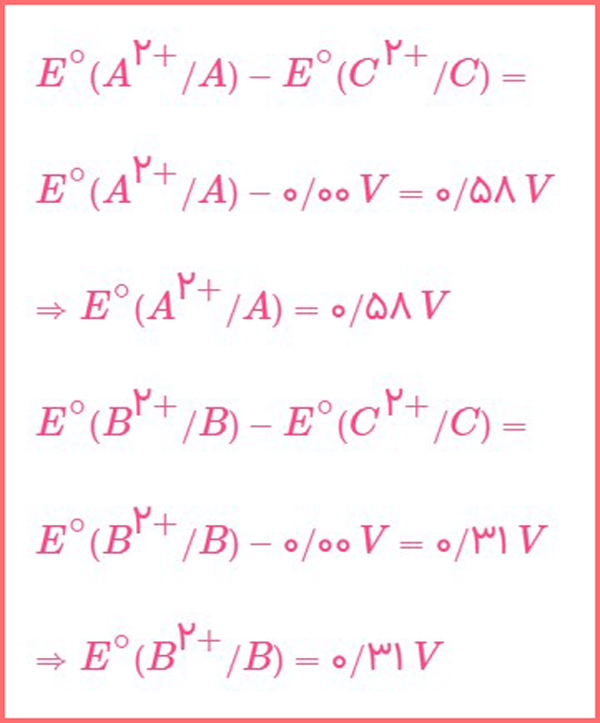
ب) نماد اکسنده ترین و کاهنده ترین گونه را بنویسید.
پاسخ: اکسنده ترین گونه فلز +A2 می باشد و کاهنده ترین گونه، فلز B می باشد.
قبلی: جواب خود را بیازمایید صفحه ۶۲ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۶۰ و ۶۱ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۵۹ شیمی دوازدهم
جواب باهم بیندیشیم صفحه ۵۷ شیمی دوازدهم
جواب خود را بیازمایید صفحه ۵۵ و ۵۶ شیمی دوازدهم
توجه: شما دانش آموز پایه دوازدهم رشته های نظری ریاضی فیزیک و تجربی می توانید برای دسترسی سریع و آسان تر به جواب تمرینات و سوالات فصل های اول تا چهارم کتاب شیمی دوازدهم متوسطه دوم ، در انتهای عنوان خود عبارت «ماگرتا» را نیز در گوگل جستجو کنید.
✅ در انتها امیدواریم که مقاله توضیح و جواب سوال های تمرین های دوره ای صفحه ۶۳ ، ۶۴ ، ۶۵ و ۶۶ فصل دوم شیمی دوازدهم تجربی و ریاضی ؛ برای شما دانش آموزان عزیز مفید بوده باشد. سوالات خود را در بخش نظرات بیان کنید.















کامل و دقیق ولی دوست عزیز برای فلزاتی ک میخواهیم ب عنوان اکسنده معرفی کنیم باید یون اونو بگیم نه خوده فلز….مثلا در مثلا 6 اکسنده میشه یون نقره نه خوده نقره چون نقره اگه اکسنده باشه میشه بار منفی ( اسکنده یعنی اونی ک الکترون میگیره) و بدین سان کل علم شیمی میره زیر سوال……..
در سوال هفتم هم برعکس جمله بالای بنده اشتباه شده ک قوی ترین و ضعیف ترین کاهنده رو یون عناصر معرفی کردین
درحالیکه در سوال 9 کاملا درست اعلام شدن.
سلام، ممنون از شما. موارد گفته شده بررسی و اصلاح شدند.
عالی و کامل❤